Sifat Koligatif Larutan
Pada tahun 1878, Ilmuwan asal Perancis, Marie Francois Raoult, meneliti tentang tekanan uap pada larutan. Ia mendapatkan bahwa perubahan uap seluruh larutan berharga sama, tidak tergantung pada zat apa yang dilarutan dalam pelarut tersebut. Inilah yang menjadi cikal bakal penemuan tentang Sifat Koligatif Larutan.
Sifat Koligatif Larutan (Colligative Properties of Solution) adalah sifat larutan yang tidak terpengaruh oleh jenis zat terlarut, melainkan hanya dipengaruhi oleh banyaknya zat terlarut. Terdapat empat sifat koligatif larutan yang dikenal umum, yaitu, Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih (ebullioscopy), Penurunan Titik Lebur/Titik Beku (cryoscopy), dan Tekanan Osmotik.
Satuan-Satuan Konsentrasi
Molaritas (M)
Molaritas adalah banyaknya mol zat dalam setiap liter larutan, dirumuskan dengan:
Molalitas (m)
Molalitas adalah banyaknya mol zat dalam setiap kilogram pelarut, dirumuskan dengan:
Persen massa (%m)
Persen massa adalah banyaknya massa zat terlarut dalam setiap 100 gram larutan, dirumuskan dengan:
Fraksi Mol (X)
Fraksi mol adalah perbandingan antara mol zat terlarut atau pelarut dengan mol larutan, dirumuskan dengan:
Nilai X akan selalu memberikan hasil Xp > Xt karena dalam suatu laruta, pelarutlah yang lebih dominan dibanding zat terlarut, karena kalau tidak, gak akan disebut pelarut-_-
Penurunan Tekanan Uap Jenuh
 |
| Mengepel merupakan salah satu cara untuk mempercepat penguapan. sumber: wikiHow |
Menguap tidaklah sama dengan Mendidih, Menguap adalah proses bagaimana cair berubah menjadi gas dan tidak harus terjadi pada suhu 373 K (100ºC), penguapan bisa terjadi karena dipengaruhi oleh tekanan uap jenuhnya.
Dengan konsep:
Semakin tinggi tekanan uap jenuh, penguapan semakin mudah terjadi.
Semakin rendah tekanan uap jenuh, penguapan semakin sulit terjadi.
Marie Francois Raoult merumuskan Hukum Roult tentang Tekanan Uap Jenuh, dengan bunyi:
Tekanan uap jenuh larutan sebanding dengan perbandingan mol pelarutnya dengan mol larutannya.Jika dirangkai secara matematis, persamaan itu akan berbunyi:
Karena nilai Perubahan tekanan uap adalah ΔP = Tekanan uap awal (P0) - Tekanan uap akhir (P), maka rumus pada Hukum Roult dapat diturunkan menjadi:
Perubahan Titik Didih dan Titik Beku
 |
| Es (air dalam keadaan padat) tidak selamanya membeku pada suhu 273 K (0 ºC) sumber: www.deqonline.com |
Ketika sebuah pelarut (seperti air, alkohol, benzena) diberi zat terlarut (seperti garam, gula) maka larutan itu akan cenderung mempertahankan wujudnya dalam keadaan cair sehingga terjadi penurunan terhadap titik bekunya dan kenaikan terhadap titik didihnya.
Penurunan Titik Beku
Pelarut yang diberi zat terlarut akan sukar membeku karena titik bekunya turun. Penurunan titik beku berbanding lurus dengan molalitas zat terlarut yang dirumuskan dengan:
Dengan Kf merupakan ketetapan penurunan titik beku dan Tf0 merupakan titik beku pelarut murni. Berikut ini adalah tabel Kf dan Tf0 beberapa pelarut yang umum:
| Pelarut | Tetapan Penurunan Titik Beku (Kf) | Titik Beku Pelarut Murni (Tf0) |
|---|---|---|
| Air | 1,86 ºC/m | 0 ºC |
| Benzena | 5,12 ºC/m | 5,45 ºC |
| Naftalena | 80,5 ºC/m | 80,5 ºC |
| Aseton | 2,40 ºC/m | -95,35 ºC |
| Fenol | 7,27 ºC/m | 43 ºC |
| Karbon Tetraklorida | 29,8 ºC/m | -23 ºC |
Kenaikan Titik Didih
Pelarut yang diberi zat terlarut akan sukar mendidih karena titik didihnya naik. Kenaikan titik didih berbanding lurus dengan molalitas zat terlarut yang dirumuskan dengan:
Dengan Kb merupakan ketetapan kenaikan titik didih dan Tb0 merupakan titik didih pelarut murni. Berikut ini adalah tabel Kb dan Tb0 beberapa pelarut yang umum:
| Pelarut | Tetapan Kenaikan Titik Didih (Kb) | Titik Didih Pelarut Murni (Tb0) |
|---|---|---|
| Air | 0,52 ºC/m | 100 ºC |
| Benzena | 2,53 ºC/m | 80 ºC |
| Naftalena | 5,8 ºC/m | 217,7 ºC |
| Aseton | 1,71 ºC/m | 56 ºC |
| Fenol | 3,04 ºC/m | 182 ºC |
| Karbon Tetraklorida | 4,95 ºC/m | 76,5 ºC |
Diagram Fase Air / Diagram P-T (Pressure-Temperature Diagram)
Perubahan fase seperti Penguapan, Pengembunan, Penyubliman, dan lain-lain tidak hanya dipengaruhi oleh suhu namun juga oleh tekanan, Air dengan suhu sangat tinggi bisa mempertahankan wujud cairnya bila juga diimbangi dengan tekanan yang sangat tinggi. Pehatikan diagram fase air berikut!
 |
| Diagram Fase Air sumber: unknown |
Cara membacanya adalah dengan menarik garis dari tegak lurus sumbu-x (suhu) dan tegak lurus sumbu-y (tekanan) maka dapat diliat dimana titik yang berpotongan akan jauh, apakah di daerah padat, cair, atau gas.
Misalkan pada Diagram Fase Air Murni, Suhu 100 ºC tekanan 1,5 atm akan memberikan air dalam fase cair, karena titik P-T jatuh pada daerah cair.
Tekanan Osmosis
 |
| Jika tekanan osmosis tidak seimbang, maka darah akan mengalir ke selang infus, bukan sebaliknya. sumber: unknown |
Tekanan Osmosis adalah tekanan yang dibutuhkan untuk mencegah terjadinya peristiwa osmosis yaitu gerakan molekul dengan kepekatan rendah menuju molekul dengan kepekatan tinggi, berkebalikan dengan peristiwa difusi.
Tekanan osmosis dirumuskan dengan:
dengan M = molaritas larutan, R = tetapan gas ideal (0,082 L.atm/mol), T = suhu mutlak (K)
Sifat Koligatif Elektrolit
Zat yang terikat secara ionik (bersifat elektrolit) memiliki sifat koligatif yang berbeda dengan zat yang terikat secara kovalen, ini dikarenakan zat elektrolit terurai dalam air menjadi beberapa molekul lain. seperti NaCl yang dalam air terurai secara sempurna menjadi Na+ dan Cl- .
Gejala ini pertama kali diteliti oleh ilmuwan bernama Van't Hoff, karena itu diberi nama Faktor Van't Hoff yang dirumuskan :
dengan n = jumlah ion yang terbentuk (misal NaCl = 2, MgCl2 = 3, AlCl3 = 4) dan α d = derajat disosiasi (untuk elektrolit kuat, α = 1)
Untuk itu, rumus-rumus diatas dapat kita lengkapi menjadi:
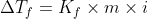

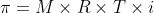
Untuk itu, rumus-rumus diatas dapat kita lengkapi menjadi:



Komentar
Posting Komentar