Stoikiometri dan Reaksi pada Pelarut Air
UTS fisika sudah selesai. Bagaimana? EZ atau sulit? Udah lupakan.. sekarang saatnya move on ke UTS kimia yang sudah di depan mata. Soal-soal di chempro memang cukup ampuh untuk menghadapi UTS kimia, tapi sayangnya tidak seperti mathco dan phiwiki, chempro tidak dilengkapi dengan rangkuman. Sementara baca buku R. Chang dan J. E. Brady tentu sangat mager :(
Bab ini juga gabungan dari dua bab: Stoikiometri dan Reaksi pada Pelarut Air. Karena bila dibuat postingan satu-satu akan jadi boros halaman dan tidak efisien :(
Konsep Mol
Mol adalah satuan mikroskopis dari jumlah partikel dalam atom/ion/molekul. Secara definisi, 1 mol adalah jumlah atom dalam 12 gram atom C-12 atau setara dengan Bilangan Avogadro, Nₐ = 6,022 x 10²³.
Mol dapat diubah menjadi besaran-besaran fisis makroskopis lain, seperti massa dan volume.
 |
| Konversi Mol |
Pereaksi Pembatas dan Persen Hasil
Pereaksi Pembatas adalah zat reaktan dengan jumlah yang lebih sedikit dibanding reaktan lainnya sehingga membatasi reaksi tidak sampai seluruh reaktannya habis.
Persen Hasil (Yield) adalah fraksi dari massa hasil sebenarnya dengan massa hasil teoritis.
Reaksi Non-Redoks
Reaksi Pengendapan
Reaksi pengendapan adalah reaksi pembentukan padatan dari ion-ion.
Zat yang Larut dan Tidak Larut dalam Air
| Larut | Tak Larut | ||
|---|---|---|---|
| Kecuali | Kecuali | ||
| Seluruh Ion IA dan NH4⁺ | - | Ion CO₃²⁻, PO₄³⁻, CrO₄²⁻, dan S²⁻ | IA dan NH4⁺ |
| Seluruh Ion NO₃⁻, HCO₃⁻, ClO₃⁻ | - | OH⁻ | IA dan Ba²⁺ |
| Ion Halogen (Cl⁻, Br⁻, I⁻) | Ag⁺, Hg₂²⁺, dan Pb²⁺ | - | - |
| SO₄²⁻ | Ag⁺, Hg₂²⁺, Pb²⁺, Ca²⁺, Sr²⁺, dan Ba²⁺ | - | - |
Reaksi Ion Netto
Reaksi Ion Netto adalah reaksi yang sebenarnya terjadi untuk membentuk endapan.
contoh:
coret ion yang sama.
Ion-ion lainnya seperti NO₃⁻ dan Na⁺ disebut sebagai ion pendamping (spectator ion) yang tidak ikut serta dalam reaksi pengendapan.
Reaksi Penetralan
Reaksi penetralan adalah reaksi yang melibatkan Asam Basa menjadi Garam.
Definisi Asam-Basa
Arrhenius
Asam: senyawa yang dalam air menghasilkan ion⁺
Basa: senyawa yang dalam air menghasilkan ion OH⁻
Brønsted
Asam: pendonor proton (H⁺)
Basa: akseptor proton (H⁺)
Lewis
Asam: akseptor elektron
Basa: donor elektron
Titrasi
Titrasi adalah salah satu contoh reaksi penetralan dimana mol asam = mol basa. Maka:
dengan:
a/b = valensi asam a/basa b (contoh: H₂SO₄ memiliki valensi asam 2, HNO₃ 1, dsb)
M = molaritas (M)
V = volume (L/mL)
Reaksi Reduksi dan Oksidasi
 |
| Karat, contoh hasil reaksi dari reduksi-oksidasi |
Bilangan Oksidasi
Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron suatu atom yang dilepaskan atau diterima atom dalam senyawa, dimana senyawa tersebut terbentuk melalui ikatan ionik. Tanda (+) dan (-) pada biloks ditulis sebelum angkanya misalnya +2, sedangkan pada muatan ditulis sesudah angkanya, misalnya 2+.
Beberapa syarat tentang biloks:



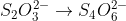

 x2
x2
 x1
x1



 (tidak bereaksi)
(tidak bereaksi)
Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron suatu atom yang dilepaskan atau diterima atom dalam senyawa, dimana senyawa tersebut terbentuk melalui ikatan ionik. Tanda (+) dan (-) pada biloks ditulis sebelum angkanya misalnya +2, sedangkan pada muatan ditulis sesudah angkanya, misalnya 2+.
Beberapa syarat tentang biloks:
- Unsur bebas memiliki biloks 0 (co: Au, Ag, Fe, dsb).
- Ion memiliki biloks yang sama dengan muatannya (co: Ag⁺, Na⁺ memiliki biloks +1, dsb).
- Senyawa netral (co: HNO₃, NaCl, dsb) memiliki total biloks 0.
- Oksigen memiliki biloks -2 jika bersenyawa (kecuali pada peroksida dan superoksida).
- IA memiliki biloks +1, dan IIA memiliki biloks +2 jika bersenyawa.
Penyetaraan Reaksi Redoks
Dalam menyetarakan reaksi redoks, ada dua metode yang dapat digunakan yaitu Setengah Reaksi dan Perubahan Bilangan Oksidasi (PBO). Namun kali ini lebih kita tekankan pada metode setengah reaksi saja.
Prinsip dari penyetaraan reaksi redoks adalah:
- Jumlah Atom sama
- Jumlah Muatan sama
- Tidak boleh ada elektron bebas terlibat dalam reaksi lagi
contoh:
Setarakan!
Setarakan!
Pisahkan atom-atom yang mengalami redoks dari senyawanya. Lalu buat reaksi untuk reduksi dan oksidasi.
Reduksi:
Oksidasi:
Gabungkan kedua reaksi diatas dengan menyetarakan elektronnya
Hasil: 
Tambahkan spectator ion yang kita hilangkan di awal tadi:
Kereaktifan
Suatu zat yang dikatakan sebagai "oksidator yang lebih kuat" mampu mengoksidasi unsur-unsur dengan kekuatan oksidator lebih lemah namun tidak berlaku sebaliknya. Jika reaksi dilakukan sebaliknya, reaksi tidak akan terjadi.
Kereaktifan, untuk logam dapat ditentukan dari deret kereaktifan logam:
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
semakin kanan, Porensial Reduksi Standar (E₀) makin besar sehingga unsur cenderung untuk reduksi dan bersifat oksidator.
Sementara untuk halogen:
F Cl Br I At
semakin ke kanan, halogen akan cenderung teroksidasi.
contoh:



Komentar
Posting Komentar