Atom, Ion, Molekul, dan Sistem Periodik
UTS fisika sudah selesai. Bagaimana? EZ atau sulit? Udah lupakan.. sekarang saatnya move on ke UTS kimia yang sudah di depan mata. Soal-soal di chempro memang cukup ampuh untuk menghadapi UTS kimia, tapi sayangnya tidak seperti mathco dan phiwiki, chempro tidak dilengkapi dengan rangkuman. Sementara baca buku R. Chang dan J. E. Brady tentu sangat mager :(
Nah di bab pertama ini campuran antara 2 bab (kalau menurut buku R. Chang) yaitu Atom, Ion, dan Molekul serta Sistem Periodik Unsur. Sementara menurut buku J. E. Brady, sudah menjadi 1 bab yaitu Unsur, Senyawa, dan Sistem Periodik.
Teori Atom Pra-Kuantum
Teori Dalton (1808)
John Dalton mengemukakan pandangannya tentang atom, yaitu:
- Atom adalah materi terkecil penyusun unsur
- Atom dari unsur-unsur yang sama adalah sama dan identik
- Senyawa adalah kumpulan atom yang tersusun atas dua atau lebih unsur
- Reaksi kimia adalah penyusunan ulang unsur-unsur
Teori J. J. Thompson (1906)
 |
| Model Atom Thompson |
Thompson beranggapan bahwa atom merupakan sebuah bola bermuatan positif dan di kulitnya terdapat elektron bermuatan negatif (seperti roti kismis). Keberhasilan di era Thompson adalah berhasil menemukan elektron sekaligus menghitung fraksi m/e (massa per muatan) dari elektron menggunakan uji sinar katoda.
Percobaan Thompson dilanjutkan oleh Milikan dengan uji tetesan minyak (Milikan's oil drop) dan berhasil mengetahui massa dari elektron sebesar 9,1 x 10⁻²⁸ gram.
Teori Rutherford (1908)
Rutherford membuktikan bahwa atom memiliki inti di tengah bermuatan positif dan dikelilingi elektron. Diantara inti dengan elektron terdapat ruang hampa yang sangat masif. Teori ini dibuktikan dengan uji penembakan sinar alpha ke inti atom emas.
 |
| Uji Sinar Alpha |
Ketika melewati sela di antara inti dengan elektron, sinar alpha diteruskan namun semakin dekat penembakannya ke arah inti, sinar alpha akan semakin dibelokkan. Hal ini menandakan sinar alpha yang bermuatan positif ditolak oleh inti atom, artinya, inti atom juga bermuatan positif.
Komponen Atom
Komponen Penyusun Atom
| Partikel | Massa (g) | Muatan | |
|---|---|---|---|
| Satuan | Coulomb | ||
| Elektron | 9,1 x 10⁻²⁸ | -1 | -1,6x10⁻¹⁹ |
| Proton | 1,672 x 10⁻²⁴ | +1 | +1,6x10⁻¹⁹ |
| Neutron | 1,674 x 10⁻²⁴ | 0 | 0 |
Nomor Massa, Nomor Atom, dan Isotop
Nomor Massa (A) = Jumlah Proton + Jumlah Neutron pada inti
Nomor Atom (Z) = Jumlah Proton pada inti
Isotop = Atom-atom sama yang memiliki nomor massa berbeda.
Menghitung Massa Atom Rata-Rata
pa,pb = kelimpahan isotop a/b di alam (dalam persen)
ArXa, ArXb = atom dengan nomor massa a/b (dalam sma)
Tata Nama Senyawa
Tata Nama Senyawa Kovalen
(Non-logam + Non logam)
Prefix + Nama Atom
beberapa prefix umum:
1 - mono
2- di
3 - tri
4 - tetra
5 - penta
6 - heksa
7 - hepta
8 - okta
9 - nona
10 - deka
contoh:
N₂O₅ = Dinitrogen Pentoksida
PCl₅ = Fosfor Pentaklorida
Tata Nama Senyawa Ionik
(Logam + Logam)
Logam (Biloks) + Nama Anion
untuk logam yang hanya memiliki 1 biloks (seperti IA, IIA) tidak perlu dituliskan biloksnya
contoh:
CsCl = Cesium Klorida
Fe₂O₃ = Besi (III) Oksida
Sifat Periodik Unsur
Sifat-sifat unsur secara periodik adalah sebagai berikut:

Jari-Jari Atomik
Jari-jari atom (atomic radii) adalah setengah dari jarak dua atom yang identik karena tidak mungkin untuk mengukur jari-jari atom secara langsung karena menurut hukum mekanika kuantum, tidak mungkin kita dapat mengetahui secara pasti posisi dari suatu elektron.
Jari-jari atom (atomic radii) adalah setengah dari jarak dua atom yang identik karena tidak mungkin untuk mengukur jari-jari atom secara langsung karena menurut hukum mekanika kuantum, tidak mungkin kita dapat mengetahui secara pasti posisi dari suatu elektron.
 |
| Jari-Jari Atom |
Semakin bertambahnya periode, jari-jari atom akan bertambah karena kulit yang semakin banyak.
Semakin bertambahnya golongan, jari-jari atom mengecil karena gaya tarik inti semakin kuat.
Jari-Jari Ionik
Jari jari kation lebih kecil daripada jari-jari atom netralnya karena hilangnya kulit keluar akibat ketidakberadaan elektron valensi. Sebagai contoh jika atom Na yang seharusnya memiliki 3 kulit mengion menjadi Na⁺ yang isoelektronik dengan Ne, yang hanya memiliki 2 kulit.
Jari-jari anion lebih besar daripada jari-jari atom netralnya karena adanya shielding effect (akan dibahas lebih lajut pada mekanika kuantum) yang menyebabkan gaya tarik inti terhadap elektron terluar melemah diakibatkan elektron pada tingkat energi lebih tinggi "diperisai" oleh elektron pada tingkat energi lebih rendah.
Energi Ionisasi
Energi Ionisasi (IE, Ionization Energy) adalah energi yang diperlukan untuk melepas sebuah elektron. Kecenderungan energi ionisasi adalah meningkat semakin tinggi golongan, namun dengan beberapa penyimpangan.
Sebagai contoh kita ambil adalah unsur-unsur periode 2 di sini:
Penyimpangan yang terjadi antara Be-B dan N-O disebabkan oleh konfigurasi elektronnya.
Be (2s²) sudah memiliki orbital yang terisi penuh dan sangat stabil sehingga untuk melepas salah satu elektronnya dan mengubahnya menjadi Be⁺ (2s¹) butuh energi yang sangat besar.
Energi Ionisasi akan cenderung meningkat semakin banyak atom yang akan dikeluarkan karena atom paling dalam ditarik oleh inti lebih kuat sehingga untuk melepasnya butuh energi yang lebih besar.
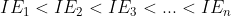
Elektronegatifitas / Keelektronegatifan
Elektronegatifitas adalah kecenderungan atom untuk menangkap elektron dan menjadi ion negatif. Indeks elektronegatifitas berkisan antara 0-4 dengan Helium menempati posisi terendah (0) dan Fluor menempati posisi paling tinggi (4).
Semakin golongan meningkat (tanpa mengikutsertakan gas mulia), elektronegatifitas akan bertambah karena atom-atom akan cenderung semakin stabil dengan cara menangkap elektron.
Sementara semakin periode meningkat, elektronegatifitas akan turun karena kulit yang banyak akan membuat gaya tarik inti terhadap elektron terluar semakin lemah karena adanya shielding effect.
Affinitas Elektron
Affinitas Elektron (EA, Electron Affinity) adalah energi yang diperlukan atau dilepaskan ketika atom menangkap sebuah elektron pada keadaan gas.
Jari-jari anion lebih besar daripada jari-jari atom netralnya karena adanya shielding effect (akan dibahas lebih lajut pada mekanika kuantum) yang menyebabkan gaya tarik inti terhadap elektron terluar melemah diakibatkan elektron pada tingkat energi lebih tinggi "diperisai" oleh elektron pada tingkat energi lebih rendah.
Energi Ionisasi
Energi Ionisasi (IE, Ionization Energy) adalah energi yang diperlukan untuk melepas sebuah elektron. Kecenderungan energi ionisasi adalah meningkat semakin tinggi golongan, namun dengan beberapa penyimpangan.
Sebagai contoh kita ambil adalah unsur-unsur periode 2 di sini:
 |
| Energi Ionisasi Unsur Periode Kedua |
Penyimpangan yang terjadi antara Be-B dan N-O disebabkan oleh konfigurasi elektronnya.
Be (2s²) sudah memiliki orbital yang terisi penuh dan sangat stabil sehingga untuk melepas salah satu elektronnya dan mengubahnya menjadi Be⁺ (2s¹) butuh energi yang sangat besar.
Energi Ionisasi akan cenderung meningkat semakin banyak atom yang akan dikeluarkan karena atom paling dalam ditarik oleh inti lebih kuat sehingga untuk melepasnya butuh energi yang lebih besar.
Elektronegatifitas / Keelektronegatifan
Elektronegatifitas adalah kecenderungan atom untuk menangkap elektron dan menjadi ion negatif. Indeks elektronegatifitas berkisan antara 0-4 dengan Helium menempati posisi terendah (0) dan Fluor menempati posisi paling tinggi (4).
Semakin golongan meningkat (tanpa mengikutsertakan gas mulia), elektronegatifitas akan bertambah karena atom-atom akan cenderung semakin stabil dengan cara menangkap elektron.
Sementara semakin periode meningkat, elektronegatifitas akan turun karena kulit yang banyak akan membuat gaya tarik inti terhadap elektron terluar semakin lemah karena adanya shielding effect.
Affinitas Elektron
Affinitas Elektron (EA, Electron Affinity) adalah energi yang diperlukan atau dilepaskan ketika atom menangkap sebuah elektron pada keadaan gas.
Reaksi Unsur Golongan Utama
IA
Golongan IA sangat reaktif bila bereaksi dengan air dan menghasilkan basa serta gas hidrogen dalam jumlah yang masif. Reaksi IA dalam jumlah besar dapat menyebabkan ledakan.
Golongan IA juga dengan oksigen membentuk oksida
IIA
Unsur golongan IIA, Be tidak reaktif dengan air, Mg reaktif dengan air panas/uap air, dan Ca, Sr, Ba cukup reaktif dengan air.
IIIA
Aluminium jika direaksikan dengan asam akan menghasilkan gas hidrogen
Aluminium jika direaksikan dengan asam akan menghasilkan gas hidrogen
IVA
Si dan C jika terikat sesamanya akan membentuk molekul raksasa seperti C₆₀ (Buckyball), Intan, dan Grafit.
 |
| Struktur Molekul Buckyball |
VA
Oksida VA jika direaksikan dengan air akan membentuk asam.
Contoh:
VIA
Oksida VIA juga jika direaksikan dengan air akan membentuk asam.
Contoh:
VIIA
VIIA jika direaksikan dengan gas hidrogen akan membentuk asam.
VIIIA
VIIIA tidak bereaksi.
VIIIA tidak bereaksi.



Komentar
Posting Komentar